ORTA KULAĞA TOPİKAL OLARAK UYGULANAN ANTİFUNGAL İLAÇLARIN OTOTOKSİK ETKİLERİNİN HİSTOPATOLOJİK İNCELENMESİ
2Celal Bayar Üniversitesi Tıp Fakültesi, KBB Anabilim Dalı, Manisa, Türkiye
3Celal Bayar Üniversitesi Tıp Fakültesi, Histoloji Anabilim Dalı, Manisa, Türkiye
Özet
Amaç: Otomikozis tedavisinde kullanılan topikal antifungal ajanların ototoksik yan etkilerinin olup olmadığı hakkında yeterli veri mevcut değildir. Bu çalışmada tolnaftat, sulkonazol, bifonazol, nistatinin ototoksik etkileri histopatolojik olarak incelendi.Yöntem ve Gereçler: 35 adet guinea pig 5 gruba ayrılarak sağ kulaklarına Tolnaftat, Sulkonazol, Bifonazol, Nistatin ve Neomisin (pozitif kontrol) uygulandı. İlaçlar hayvanların sağ timpanik kavitelerine topikal olarak bir haftada üç kez uygulandı. Sol kulakları negatif kontrol grubu olarak değerlendirildi. Tedaviden 2 hafta sonra hayvanlar sakrifiye edilerek kohleaları ışın mikroskopisinde incelendi. TUNEL boyaması yapılarak spiral limbus ve spiral gangliyondaki apopitotik hücre oranları belirlendi.
Bulgular: Tolnaftat ve bifonazol uygulanan kulaklarda sulkonazol ve nistatin uygulananlara göre çok daha fazla sayıda apopitotik hücre tespit edildi. Ayrıca bu etkiler sadece spiral limbusda değil spiral gangliyonda da gözlenmiştir.
Sonuç: Antifungal ajanlar ototoksisiteye neden olabilirler. Timpan membran perforasyonu olan vakalarda topikal antifungal tedavi için bu etkilerin daha az olduğu sulkonazol ve nistatinin kullanılması daha emniyetli olur.
Giriş
Otomikozis KBB pratiğinde sık karşılaşılan hastalıklardan biridir[1-3]. Otomikozisin tedavisinin hedefleri; semptomların düzeltilmesi, hastalığın eliminasyonu ve rekürrensin önlenmesidir. Bu amaçla tedavi seçeneklerinin başında dış kulak kanalı (DKK)'nın sık temizlenmesi ve kuru bir ortam elde edilmesi (topikal olarak uygulanan borik asit, asetik asit vb kullanımı ile) gelmektedir. Ancak bu tedavi ile olan sonuçların daha da iyileştirilmesine yardımcı olmak için DKK'na topikal olarak antifungal ajanların kullanımı da önerilmektedir[1-6].Topikal ilaç kullanımının riskli olabileceği bazı durumlar mevcuttur. Bunlar; ventilasyon tüpü (VT) olan hastalar, timpan membran perforasyonu olan hastalar, açık mastoid kavitesi olan hastalardır. Topikal olarak kullanılan antifungal ilaçlar yuvarlak pencereden diffüzyonla kohleaya geçebilirler[7]. Ancak bu ilaçların ototoksik özelliklerinin olup olmadıklarına dair literatürde fazla bir veri yoktur[8,9].
Bu çalışmanın amacı; topikal antifungal ajanların ototoksik olup olmadıklarının saptanması ve eğer ototoksisite var ise bunun apoptozis mekanizması ile olup olmadığının araştırılmasıdır.
Yöntem ve Gereçler
Bu çalışmada 35 adet guinea pig kullanılmıştır. Çalışma öncesi Celal Bayar Üniversitesi Tıp Fakültesi Bilimsel Araştırmalar Etik Kurul onayı alınmıştır (2002-80). Tüm hayvanlar "Laboratuar Hayvanlarının Bakım ve Kullanımı Kılavuzu'na uygun olarak insancıl bir muameleye tabi tutulmuştur.Hayvanlar 7'şerli 5 gruba ayrılmışlar ve sağ kulaklarına sırasıyla Tolnaftat, Sulkonazol, Bifonazol, Nistatin ve Neomisin (pozitif kontrol grubu olarak) uygulandı. Her bir gruptan 2 şer hayvanın sol kulakları ise negatif kontrol grubu olarak incelendi.
İlaçlar intraperitoneal ketamin + xylizin anestezi altında 1 haftada toplam üç kere olmak üzere, timpan membran posterior kadranından dental iğne ile orta kulağı tamamen dolduracak şekilde verildi. Tedavi bitiminden 2 hafta sonra hayvanlar intrakardiyak ketamin verilerek sakrifiye edildi. Temporal kemikleri diseke edilip dışarı alındıktan sonra kohleaları Gluteraldehit solüsyonu içinde tesbit edildi. Kohlealar ışık mikroskopisi (H-E ve TUNEL) altında incelendi. Korti organı, spiral limbus (SL), spiral gangliyon (SG) hücreleri incelendi. TUNEL boyaması ile pozitif olarak boyanan apopitotik hücre sayısı 100 hücre üzerinden orantısal olarak hesaplandı.
Bulgular
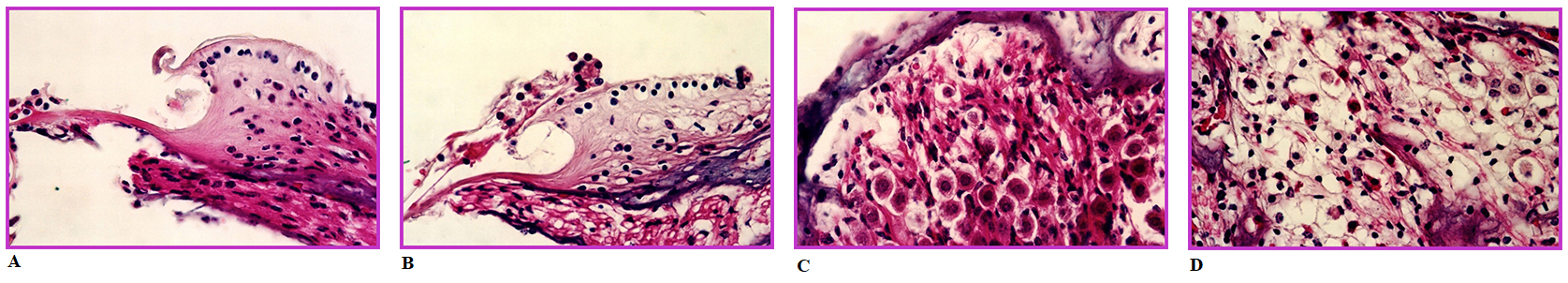
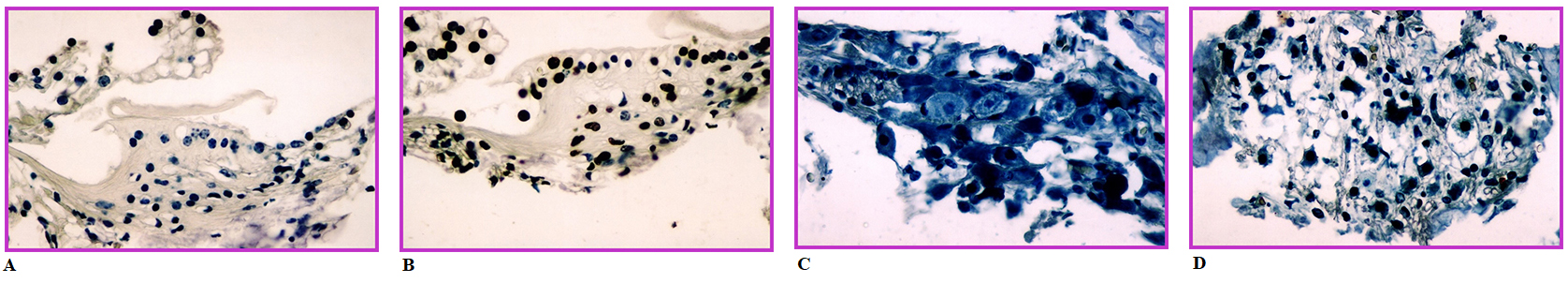
Resim 1'de negatif ve pozitif kontrol grubunda spiral limbus ve spiral gangliyonda HE boyama ile izlenen histolojik değişiklikler görülmektedir. Negatif kontrol grubundakilere göre hücrelerde ödem ve belirgin dejenerasyon izlenmektedir. Antimikotik ajanların sebep olduğu değişiklikler pozitif kontrol grubunda izlenen değişikliklerle aynı türden olup dereceleri farklılık göstermektedir.Resim 2'de ise negatif ve pozitif kontrol grubunda spiral limbus ve spiral gangliyonda TUNEL boyama görüntüleri izlenmektedir. Pozitif kontrol grubunda negatif kontrol grubuna göre koyu renkli olarak izlenen TUNEL (+) hücrelerin varlığı dikkat çekmektedir.
Çalışma gruplarındaki TUNEL (+) boyanan hücre oranları Tablo 1"de verilmiştir. Tüm antifungal ilaçlarda (+) kontrol grubuna göre daha az olmakla beraber TUNEL pozitif hücre varlığı dikkati çekmektedir. Ancak Tolnaftat ve Bifonazol'de bu oranın Sulkonazol ve Nistatine göre daha fazla olduğu izlenmektedir. Ayrıca spiral gangliyon hücrelerinde de spiral limbusta görülen apopitotik hücre sayısına yakın sayıda TUNEL (+) hücre varlığı dikkat çekmektedir.
 Büyütmek İçin Tıklayın |
Resim 1: Negatif (Resim 1A - 1C) ve pozitif (Resim 1B - 1C) kontrol gruplarında HE boyaması görüntüleri. Pozitif kontrol grubunda hücrelerdeki dejenerasyon ve ödem varlığı dikkat çekmektedir. Resim 1A-1B spiral limbus kesitleri, Resim 1C-1D spiral gangliyon kesitleri |
 Büyütmek İçin Tıklayın |
Resim 2: Negatif (Resim 2A - 2C) ve pozitif (Resim 2B - 2C) kontrol gruplarında TUNEL boyama görüntüleri. Pozitif kontrol grubunda koyu renkli TUNEL (+) hücreler izlenmektedir Resim 2A - 2B spiral limbus kesitleri, Resim 2C - 2D spiral gangliyon kesitleri |
Tablo 1: TUNEL (+) boyanan hücre oranları. SL- Spiral Limbus, SG- Spiral ganglion.
Tartışma
Topikal olarak kullanılan antifungal ajanların ototoksisitesi hakkında literatürde çok az çalışma mevcuttur. Marsh ve Tom 1989'da guinea piglerde ABR eşik değerlerini değerlendirmişler ve M-cresyl asetat, Asetik asit, Klotrimazol ve Tolnaftat kullanımı sonrasında ABR eşik değerlerinde değişiklik olmadığını rapor etmişlerdir[8]. Tom, Klotrimazol, Tolnaftat, Mikonazol ve Nistatin kullanımının tarama elektron mikroskopik incelemelerinde guinea piglerde tüylü hücre kaybına yol açmadıklarını bildirmektedir[9]. Bizim çalışmamızda ise TUNEL yöntemi kullanılarak topikal olarak kullanılan antifungal ajanların değişik derecelerde apopitozise neden olabileceği gösterilmiştir (Tablo 1). Bunlar içinde Tolnaftat ve Bifonazol kullanımının Sulkonazol ve Nistatin kullanımına göre çok daha fazla apopitozis gelişimine neden olduğu gözlenmiştir.Apopitozis tek tek hücre ölümü demektir. Apopitotik değişiklik gösteren hücre için ölüm süreci başlamış demektir. Karakteristik olarak sağlam bir hücre membranı mevcuttur ve komşu hücrelerden ayrılma izlenir. Apopitozise giden bir hücrede görülen diğer hücresel değişiklikler ise hacim kaybı, parçalı çekirdek, sitoplamik vakuoller, kondanse kromatin ağı varlığı, endoplazmik retikulumda dilatasyon şeklinde özetlenebilir (Resim 2).
Apopitozisin ototoksisitede rol oynayan önemli mekanizmalardan biri olduğu çeşitli hayvan çalışmalarında gösterilmiştir. Xu ve ark. sisplatin verilmiş sıçanlarda apopitozisin SG ve korti organında hasara neden olan esas mekanizma olduğunu vurgulamışlardır[10]. Lee ve ark. ise fare iç kulağına direkt olarak verilen sisplatinin mitokondriyal apopitotik sinyal yolunu kullanarak apopitozise neden olduğunu göstermişlerdir[11].
Bizim çalışmamızdaki diğer bir önemli bulgu da kullanılan ajanların neden olduğu apopitozisin aynı zamanda SL ve SG hücrelerinde de görülmesidir. Bu literatürde yer alan bazı bulgularla paraleldir. Sone ve ark. Tobramisin kullanılmış kistik fibrozisli hastaların temporal kemiklerinin incelenmesinde SG hücrelerinde dejenerasyon saptamışlar[12]. Yine Hoeffer ve ark. transtimpanik Gentamisin uygulamasının SG hücrelerinde erken hasara yol açtığını göstermişlerdir[13]. Bizim çalışmamızda pozitif kontrol olarak kullandığımız Neomisin de benzer şekilde SG hücrelerinde apopitozis gelişimine neden olmuştur. Aynı gözlemlerin antifungal ajanların tatbikinden sonra da görülmesi genel olarak ototoksisitede SG hücrelerinin de harabiyete uğrayabildiklerini göstermektedir. Bu da ototoksik ajanların kullanımına bağlı kalıcı sensorinöral işitme kaybını açıklamaktadır.
Sonuç
Topikal antifungal ajanlar değişik oranlarda olsa da ototoksik yan etkileri olabilir. Tolnaftat ve Bifokonazol'de bu etki daha belirgindir. Ancak guinea pig ile insan yuvarlak pencere membranı arasındaki farklılıklar nedeniyle bu bulguların insanlardaki değeri dikkatle yorumlanmalıdır. Ancak yine de timpan membran perforasyonu olan olgularda kullanılacaksa daha az ototoksisiteye sahip olduğu gösterilen Sulkonazol ve Nistatinin tercih edilmesi daha uygun olacaktır.
Maddi ve Teknik destek:
Bu çalışma Celal Bayar Üniversitesi Araştırma Fonu tarafından desteklenmiştir.
Çıkar çatışması:
Yazarların bu makale içeriği ile ilgili herhangi bir çıkar çatışması yoktur.
Kaynaklar
1) Ozcan KM, Ozcan M, Karaarslan A, Karaarslan F. Otomycosis in Turkey: predisposing factors, aetiology and therapy. J Laryngol Otol 2003; 117:39-42. [ Özet ]
2) Lucente FE. Fungal infections of the external ear. Otolaryngol Clin North Am 1993; 26:995-1006. [ Özet ]
3) Paulose KO, Al Khalifa S, Shenoy P, Sharma RK. Mycotic infection of the ear (otomycosis): a prospective study. J Laryngol Otol 1989; 103:30-35. [ Özet ]
4) Schönebeck J, Zakrisson JE. Topikal 5-fluorocytosine therapy in otomycosis. J Laryngol Otol 1974; 88:227-231. [ Özet ]
5) Bassiouny A, Kamel T, Moawad MK, Hindway DS. Broad spectrum antifungal agents in otomycosis. J Laryngol Otol 1986; 100:867-873. [ Özet ]
6) Stern JC, Shah MK, Lucente FE. In vitro effectiveness of 13 agents in otomycosis and review of the literature. Laryngoscope 1988; 98:1173-1177. [ Özet ]
7) Spandow O, Anniko M, Moeller AR. The round window as access route for agents injurious to the inner ear. Am J Otolaryngol 1988; 9:327-335. [ Özet ]
8) Marsh RR, Tom LW. Ototoxicity of antimycotics. Otolaryngol Head Neck Surg 1989; 100:134-136. [ Özet ]
9) Tom LW. Ototoxicity of common topical antimycotic preparations. Laryngoscope 2000; 110:509-516. [ Özet ]
10) Xu HJ, Huang WN. Cisplatin-induced apoptotic cell death in spiral ganglion and organ of Corti of mongolian gerbil cochlear. Zhonghua Er Bi Yan Hou Ke Za Zhi 2003; 38:98-100. [ Özet ]
11) Lee JE, Nakagawa T, Kim TS, Iguchi F, Endo T, Dong Y, Yuki K, Naito Y, Lee SH, Ito J. A novel model for rapid induction of apoptosis in spiral ganglions of mice. Laryngoscope 2003; 113(6):994-999. [ Özet ]
12) Sone M, Schachern PA, Paparella MM. Loss of spiral ganglion cells as primary manifestation of aminoglycoside ototoxicity. Hear Res 1998; 115:217-223. [ Özet ]
13) Hoeffer ME, Allen K, Kopke RD, Weiskopf P, Kim Gottshall K, Wester D. Transtympanic versus sustained-release administration of gentamicin: kinetics, morphology, and function. Laryngoscope 2001; 111:1343-1357. [ Özet ]




