KRONİK OBSTRUKTİF AKCİĞER HASTALARINDA KRONİK HİPOKSİNİN KOKLEADAKİ DIŞ TÜYLÜ HÜCRE FONKSİYONLARINA ETKİSİ
2Yıldırım Beyazıt Üniversitesi, KBB Kliniği, Ankara, Türkiye
3Selçuk üniversitesi, Odyoloji bölümü, Ankara, Türkiye
Özet
Amaç: Bu çalışmada Kronik Obstrüktif Akciğer Hastalığında (KOAH), ağırlık skoruna göre sınıflandırılarak, kronik hipoksinin işitme fonksiyonlarına ve kokleadaki dış tüylü hücre fonksiyonlarına etkisini araştırmak amaçlanmıştır.Materyal- Metod: Bu çalışmada Ocak 2014 ile Aralık 2014 tarihleri arasında KBB polikliniğine daha önce KOAH tanısı alarak başvuran 25 hasta değerlendirilmiştir. 25 KOAH tanılı hasta (16 E, 9 K ort yaş 59,1± 9,06 (43-76)) ve 17 kontrol grubu hasta (10 E, 7 K ort yaş 57,03 ± 7,4 (44-77)) çalışmaya dahil edildi. Distorsion Product Otoacustik Emisyon (DPOAE), Transient Otoakustik Emisyon (TEOAE) ve yüksek frekans odyometrisi testleri yapılan hastalar KOAH ağırlık skoruna göre sınıflandırılarak, kontrol grubu ile karşılaştırıldı.
Bulgular: KOAH'lı hastalar ile kontrol grupları arasında 1500, 2000 ve 3000 Hz'deki medyan DPOAE düzeyleri yönünden istatistiksel olarak anlamlı fark yokken, 4000, 6000 ve 8000 Hz'deki medyan DPOAE düzeyi kontrol grubuna göre vaka grubunda istatistiksel anlamlı olarak daha düşüktü. KOAH ağrılık skoru ile DPOAE, TEOAE ve yüksek frekans odyometri sonuçları istatistiki olarak anlamlı bir korelasyon görülmese de KOAH ağırlık skoru arttıkça otoakustik emisyon yanıtlarının azaldığı ve yüksek frekans odyometrisinde işitmenin olumsuz etkilendiği görüldü.
Sonuç: Bu çalışmada KOAH'lı hastalarda kronik hipoksinin DPOAE yanıtlarını yüksek frekanslarda azalttığı, KOAH ağırlık skoru arttıkça istatistiki olarak anlamlı bulunmasada DPOAE, TEOAE yanıtları ve yüksek frekans odyometrisi sonuçlarında olumsuz etkilenme izlenmiştir.
Giriş
Kronik obstrüktif akciğer hastalığı (KOAH), birçok ek hastalığı beraberinde getiren ve hemen hemen vücudun bütün sistemlerini etkileyebilen bir hastalıktır [1,2]. Vücutta santral sinir sistemi oluşanlarının hipoksiye direnci düşük olduğundan kronik hipoksiye bağlı olarak çoğunlukla subklinik seyreden birçok periferik nöropati semptomları KOAH'a eşlik etmektedir[3,4,5]. Otoakustik emisyon testleri ilk kez 1978'de Kempt [6] tarafından keşfedildiğinden bu yana birçok klinik çalışmada yaygın olarak kullanılmaktadır. Basit, uygun maliyetli ve frekansa spesifik dış tüylü hücre fonksiyonlarını objektif değerlendirebilmesi nedeniyle klinik çalışmalarda tercih sebebi olmuştur.Otoakustik emisyon dış tüylü hücrelerin vibratuar hareketlerinden kaynaklanır ve baziler membran ve dış tüylü hücrelerin bağlantısı, dalganın stapedial food plate ve dış kulak yoluna iletilmesine yol açar[7,8]. Nörosensoriyel işitme kaybının mevcut olduğu patolojilerin belirlenmesi ve koklear fonksiyonun değerlendirilmesinde tercih edilen işlemdir[9].Yapılan birçok çalışmada işitme kaybı semptomları oluşmadan, kokleada oluşan hasar tespit edilmiştir [10].
Yüksek frekanslarda başlayan işitme kayıpları genellikle başlangıç aşamasında asemptomatik seyreder ve özellikle gürültü, hipoksi, bazı ototoksik ajanlar nedeniyle oluşan işitme kayıpları yüksek frekanslardan başlayabilir[11]. İşitme kaybının araştırılması ve değerlendirilmesi açısından özellikle başlangıç aşamasındaki problemleri araştırırken yüksek frekans odyometrisi de önemli bilgiler vermektedir.
Biz bu çalışmada KOAH hastalarında KOAH ağırlık skoruna göre sınıflandırarak, özellikle kronik hipoksiye bağlı olarak dış tüylü hücre fonksiyonları ve işitmeyi değerlendirmek amacıyla DPOAE. TEOAE ve yüksek frekans odyometri yanıtlarını karşılaştırmayı amaçladık.
Yöntem ve Gereçler
Bu çalışmada Ocak 2014 - Aralık 2014 tarihleri arasında kulak burun boğaz polikliniğine başvuran, 26 KOAH tanılı hasta retrospektif olarak incelendi. Bu hastalardan elde edilen veriler aynı tarihler arasında KBB polikliniğine başvuran 17 kontrol hastasının verileri ile kıyaslandı. Solunum fonksiyon testi yapılarak KOAH tanısı alan hastalara hafif, orta ve ağır olarak 1-3 arasında KOAH ağırlık skorlaması yapıldı. Her iki gruptaki hastaların poliklinik değerlendirmesinde DPOAE, TEOAE ve yüksek frekans odyometri testleri kaydedildi. Spesifik bir işitme kaybı (konjenital, posttravmatik, postenfektif vs), kronik otitis media, ototoksik ilaç kullanım öyküsü, otoskleroz, ani işitme kaybı öyküsü, akustik travma öyküsü olanlar çalışmaya dahil edilmedi. İşitme kaybına neden olabilecek kronik ek hastalığı olan hastalar (DM, otoimmun hastalıklar, KAH vb) çalışma dışı bırakıldı.Distorsiyon ürünü otoakustik emisyonlar (Distortion Product Otoacoustics Emission- DP-OAE) Madsen Capella GN Otometrics Cochlear Emisyon Analizerin (Taastrup, Denmark) diagnostik modunda ölçüldü. Ölçümler faraday kafesinin mevcut olduğu sessiz odada yapıldı. f1 ve f2 frekansları için iki farklı hoparlör ile bir hassas mikrofon kullanıldı. f2 ve f1 frekansları arasındaki oran (f2/f1) 1.22 olarak ayarlandı. Uyaran şiddeti f1 frekansı için L1, ve f2 frekansı için L2 olarak alındı ve L1-L2 10 dB SPL (L1=65, L2=55) düzeyinde tutuldu. DP-OAE 2f1-f2 DP1 modunda yapıldı. Sonuçlar birincil tonların (f1 ve f2) geometrik merkez frekanslarında (0.75, 1.0, 1.5, 2.0, 3.0, 4.0, 6.0, 8.0 kHz) gösterildi. Ölçüm boyunca 1000 sweep tüm hastalarda standart olarak sabitlendi. DP-OAE sonuçlarının değerlendirilmesinde "sinyal gürültü oranı-SNR" 6 dB ve üstündeki değerler anlamlı kabul edildi.
TE-OAE kayıtları Madsen A/S Capella Cochlear Otoakustik Emisyon Analizörü (Taastrup-Denmark) ile IBM bilgisayar ve Etymotic Research ER-2 earphones ile kaydedilmiştir. Frekans ranjı 750-4500 Hz, şiddet seviyesi 30-80 dB SPL arasında seçilmiştir. Reproducibility (tekrarlanabilirlik) %70, sinyal gürültü oranı ise tüm frekanslarda 3 dB SPL olarak kabul edilmiştir. Tüm katılımcılar için TEOAE cevaplarını (emission strength/dB), tekrarlanabilirliği (reproducibility/correlation/%) ve sinyal/gürültü oranını (S/N Ratio/dB) kaydettik. Yüksek frekans saf ses işitme eşikleri Madsen Orbiter 922 ile 8, 10, 12.5, 14 ve 16 kHz' lerde DD450 High Frequency Headset ile tespit edilmiştir.
İstatistiksel analiz için Windows SPSS 11.5 programı (SPSS Inc., Chicago, IL, United States). Sürekli değişkenlerin normal dağılıp dağılmadığı Shapiro Wilk testi kullanılarak belirlendi. Veriler, ortalama ± SD veya ortanca (min-max) olarak gösterilmiştir. Olgu ve kontrol grupları arasındaki medyan farklar Mann Whitney U testi ile karşılaştırıldı. KOAH ağırlık skorları ve diğer klinik ölçümler arasındaki ilişki dereceleri (yüksek frekanslı odyometri, DPOAE ve TEOAE) Spearman'ın Rank Correlation analizleri ile değerlendirildi. P değerinin 0.05'ten küçük olması istatistiksel olarak anlamlı kabul edildi.
Bulgular
Yapılan muayene ve solunum fonksiyon testleri sonucu KOAH ağırlık skoru hesaplanan 25 hasta (16 E, 9 K ort. yaş 59,1± 9,06 (43-76)) ve kontrol grubundaki 17 hasta (10 E, 7 K ort. yaş 57,03 ± 7,4 (44-77)) karşılaştırıldı. Gruplar arası yapılan demografik incelemede istatistiki olarak anlamlı farklılık saptanmadı. (p>0,05). Kontrol grubunun yaş ortalaması 57,03±7,4 (yıl) iken vaka grubunun yaş ortalaması 59,1±9,06 (yıl) olup gruplar arasında yaş ortalamaları yönünden istatistiksel olarak anlamlı farklılık görülmedi (p=0,440). Kontrol grubundaki olguların 10'u (%58,8) erkek, 7'si (%41,2) kadınlardan oluşmaktayken vaka grubundaki olguların 16'sı (%64,0) erkek, 9'u (%36,0) kadın olup gruplar arasında cinsiyet dağılımı yönünden de istatistiksel olarak anlamlı fark yoktu (p=0,735).Vaka grubu kendi içerisinde klinik bulgular, KOAH ağırlık skoru ve demografik özelliklerine göre değerlendirildi (Tablo 1).
KOAH ağırlık skoruna göre 1 olgu Evre 1, 18 olgu Evre 2, 6 olgu ise Evre 3 idi.
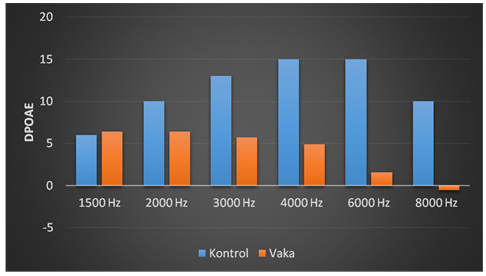
Vaka ve kontrol grupları arasında 1500, 2000 ve 3000 Hz'deki medyan DPOAE düzeyleri yönünden Bonferroni Düzeltmesine göre istatistiksel olarak anlamlı fark yokken 4000, 6000 ve 8000 Hz'deki medyan DPOAE düzeyi kontrol grubuna göre vaka grubunda istatistiksel anlamlı olarak daha düşüktü (Tablo 2). (Şekil 1)
Tablo 2: Kontrol ve vaka gruplarına göre gözlemleri DPOAE düzeyleri
 Büyütmek İçin Tıklayın |
Sekil 1: Kontrol ve vaka gruplarında her bir frekansta medyan DPOAE düzeyleri |
Vaka grubu içerisinde KOAH ağırlık skoru ile yüksek frekans odyometri ölçümleri arasında Bonferroni Düzeltmesine göre istatistiksel olarak anlamlı korelasyon görülmemiştir (p>0,0125) (Tablo 3).
Vaka grubu içerisinde KOAH ağırlık skoru ile DPOAE ölçümleri arasında Bonferroni düzeltmesine göre istatistiksel olarak anlamlı korelasyon görülmemiştir (p>0,00625) (Tablo 4)
Vaka grubu içerisinde KOAH ağırlık skoru ile TEOAE ölçümleri arasında Bonferroni düzeltmesine göre istatistiksel olarak anlamlı korelasyon görülmemiştir (p>0,010). (Tablo 5)
Tartışma
KOAH, solunum fonksiyonlarını progresif olarak bozan ve kronik hipoksi ile karakterize, çok sayıda komorbiditeye neden olan multi sistem hastalığıdır[1]. KOAH hastalarında, özellikle akut alevlenme sırasında sistemik enflamasyon bulguları ve çeşitli inflamatuar sitokinlerin (TNF alfa ,İL -6, İL 8 ) sirkulasyonda ve bronko alveolar lavaj sıvısında arttığı saptanmıştır. Bu sitokinler ve oluşan sistemik enflamasyon, KOAH'ın sistemik bulguları ve komorbid hastalıkların oluşmasına neden olmaktadır[12,13,14].İç kulaktaki transmisyon mekanizması ve impulsların transmisyonu büyük oranda koklear oksijen desteğine bağlıdır[15]. Oksijen desteğindeki belirgin azalma işitsel impuls transmisyonunu etkileyerek işitme kaybına yol açabilmektedir[16]. Koklear oksijen seviyesinin düşmesi, koklear ve endolenfatik potansiyelleri etkilemektedir[17].
KOAH' ın isitsel fonksiyonlara etkisi ile ilgili literatürde farklı sonuçlar elde edilmiştir. Bayat ve ark.[18] tarafından 2018 yılında 16 prospektif çalışmanın değerlendirildiği metaanalizde KOAH hastalarında saf ses işitme eşikleri ve ABR dalga latanslarının kontrol grubu ile karşılaştırıldığı çalışmalar incelenmiş, işitme eşiklerinde saf ses odyometrisinde ve ABR dalga latanslarında yükselme saptandığı belirtilmiştir. Gupta ve ark.[16] KOAH'lı hastalarda ABR parametrelerinde kontrol grubuna göre belirgin azalma saptamışlardır. Yüce ve ark.[19] yaptıkları çalışmada sigara kullanım süresi ile signal/noise ratio oranları arasında istatistiki olarak anlamlı bir ilişki bulmuşlardır. Tüketilen sigara miktarları ile değil sigara kullanım süresi yani hipoksinin kronikleşmesi ile otoakustik emisyonlarda anlamlı değişmeler saptanmıştır[19]. Abdel Dayem ve ark[20] yaptıkları çalışmada KOAH hastalarında düşük frekanslara göre yüksek frekanslarda işitme eşiklerinde belirgin azalma saptamışlardır. 2019 yılında 60 hastanın değerlendirildiği diğer bir prospektif çalışmada KOAH hastalarında, kontrol grubuna göre DPOAE yanıtlarında azalma ve ABR I-V dalga latansında uzama olduğu gösterilmiştir[21]. Parlewar ve ark.[22] yaptığı 100 hastanın değerlendirildiği, KOAH hastalarında işitsel fonksiyonların ABR dalga latansı ile değerlendirdikleri çalışmada, kontrol grubuna göre latanslarda belirgin uzama saptamışlardır. Hafez ve ark.[23] 2009 yılında yaptıkları çalışmada benzer şekilde KOAH hastalarında sağlıklı kontrol grubuna göre ABR latanslarında uzama saptanmıştır. Bu çalısmalar bizim çalışmamızdaki bulgular ile örtüşmektedir. Bizim çalışmamızda vaka ve kontrol grupları arasında 1500, 2000 ve 3000 Hz'deki medyan DPOAE düzeyleri yönünden istatistiksel olarak anlamlı fark yokken 4000, 6000 ve 8000 Hz'deki medyan DPOAE düzeyi kontrol grubuna göre vaka grubunda istatistiksel olarak anlamlı derecede düşüktü. (p <0,001) Daha önce birçok çalışmada alkol, sigara gibi alışkanlıkların ve diyabet, böbrek hastalıkları gibi kronik hastalıkların işitme üzerindeki olumsuz etkisi gösterilmiştir[24].
Hall ve arkadaşları hem postmortem incelemelerde hem de birçok hayvan çalışmasında işitsel nükleuslarının oksijensizliğe dayanıklılığının beynin kortikal nükleuslarından çok daha zayıf olduğunu göstermişlerdir[25]. Bu durum KOAH'da ortaya çıkacak olan kronik hipoksi ortamının birçok santral sinir sistemi fonksiyonunu olumsuz etkilemeden önce işitsel fonksiyonlar üzerinde yapabileceği olumsuz etkiyi açıklamaktadır.
Bu çalışmaların tersine Nakano ve ark.[26] ve Barbieri ve ark.[27] yaptıkları çalışmalarda kronik respiratuar hastalıklar ve ABR parametreleri arasındaki ilişkiyi araştırdıkları çalışmalarda istatiksel olarak anlamlı farklılık saptanmamıştır. Ancak bizim çalışmamızda bu çalışmalardan farklı olarak ABR eşiklerinin değil, DPOAE, TEOAE yanıtları ve yüksek frekans odyometrisi bulguları değerlendirilmiştir. DPOAE düzeyleri yönünden 4000, 6000 ve 8000 Hz'deki medyan DPOAE düzeyi kontrol grubuna göre vaka grubunda istatistiksel olarak anlamlı derecede düşük saptanmıştır.
Çalışmamızda KOAH ağırlık skoru ile DPOAE, TEOAE ve yüksek frekans odyometri sonuçları KOAH ağırlık skoru arttıkça istatistiki olarak anlamlı bulunmasada DPOAE, TEOAE yanıtları ve yüksek frekans odyometrisi sonuçlarında olumsuz etkilenme izlenmiştir. Bu nedenle genişletilmiş hasta sayısı ile planlanmış prospektif çalışmalarla değerlendirilmesi uygun olacaktır.
Sonuç
KOAH hastalarında , kronik hipoksi sonucu, hem dış tüylü hücre fonksiyonlarında hem de işitsel nöral yollarda hasar meydana gelmektedir. 1500, 2000 ve 3000 Hz'deki düşük frekanslarda medyan DPOAE düzeyleri yönünden etkilenme olmamasına rağmen, 4000, 6000 ve 8000 Hz'deki yüksek frekanslarda medyan DPOAE düzeyi belirgin düşme saptanmıştır. KOAH ağırlık skoru ile DPOAE, TEOAE ve yüksek frekans odyometrisi arasındaki ilişkiyi değerlendirmek için genişletilmiş hasta sayıları içeren çalışmalara ihtiyaç vardır.Bu çalışmada çıkar çatışması ve finansal destek bulunmamaktadır.
Kaynaklar
1) Baty F, Putora PM, Isenring B, Blum T, Brutsche M.. Comorbidities and burden of COPD: a population based case-control study. PLoS One. 2013 May 17;8(5):e63285. [ Özet ]
2) Kunik ME, Roundy K, Veazey C, Souchek J, Richardson P, Wray NP, Stanley MA. Surprisingly high prevalence of anxiety and depression in chronic breathing disorders. Chest2005;127:1205-11. [ Özet ]
3) Faden A, Mendoza E, Flynn F. Subclinical neuropathy associated with COPD: Possible pathophysiological role of smoking. Arch. Neurol. 1981; 38: 639-42. [ Özet ]
4) Narayan M, Ferranti R. Nerve conduction impairment in patients with respiratory insufficiency and severe chronic hypoxemia. Arch. Phys. Med. Rehabil. 1978; 59: 188-92. [ Özet ]
5) Moore N, Lerebours G, Senant J, Ozenne G, David P, Nouvet G. Peripheral neuropathy in chronic obstructive lung disease. Lancet 1985; 2 (8467): 1311. [ Özet ]
6) Kemp DT. Stimulated Acoustic Emissions from Within the Human Auditory System. Journal of Acoustic Society of America 1978;64:1386-1391. [ Özet ]
7) Beth A Prieve, Tracy S Fitzgerald (2002) Chapter 22, otoacousticemissions. In: JackKatz (eds) Handbook of clinical audiology, 5th ednLippincott Williams, Philadelphia, pp 440-466
8) Rosenfeld RM, Culpepper L, Doyle KJ, Grundfast KM, Hoberman A, Kenna MA, Lieberthal AS, Mahoney M, Wahl RA, Woods CR Jr, Yawn B. Clinical practice guideline: Otitis media with effusion. Otolaryngol Head Neck Surg 2004;130(5 Suppl):S95-118. [ Özet ]
9) Kimberley BP. Applications of distortion-productemissionsto an otologicalpractice. Laryngoscope 1999,109(12):1908-1918. [ Özet ]
10) Erdem T, Ozturan O, Miman Mc. Exploration of the Early Auditory Effects of Hyperlipoproteinemia and Diabetes Mellitus Using Otoacoustic Emissions. Eur Arch Otorhinolaryngol 2003;260(2):62-6. [ Özet ]
11) Ardic FN, Topuz B, Ozuer MZ. Standardization in measuring high frequency hearing threshold. [Article in Turkish] Kulak Burun Bogaz Ihtis Derg 1998;5:185-9.
12) Barnes PJ. The cytokine network in COPD. Am J Respir Cell Mol Biol. 2009;41:631-638. [ Özet ]
13) Austin V, Crack PJ, Bozinovski S, Miller AA, Vlahos R. COPD and stroke: are systemic inflammation and oxidative stress the missing links? Clin Sci. 2016;130(13):1039-1050. [ Özet ]
14) Barnes PJ, Celli BR. Systemic manifestations and comorbidities of COPD. Eur Respir J. 2009;33(5):1165-1185. [ Özet ]
15) Gupta PP, Sood S, Atreja A, Agarwal D. A comparison of cognitive functions in non-hypoxemic chronic obstructive pulmonary disease (COPD) patients and age-matched healthy volunteers using mini-mental state examination questionnaire and event-related potential, P300 analysis. Lung India. 2013;30(1):5-11. [ Özet ]
16) Gupta PP, Sood S, Atreja A, Agarwal D. Evaluation of brain stem auditory evoked potentials in stable patients with chronic obstructive pulmonary disease. Ann Thorac Med. 2008;3(4):128-134. [ Özet ]
17) Johnstone BM, Sellick PM. The peripheral auditory apparatus. Q Rev Biophys. 1972;5(1):1-57. [ Özet ]
18) Bayat A, Saki N, Nikakhlagh S, Mirmomeni G, Raji H, Soleimani H, Rahim F. Is COPD associated with alterations in hearing? A systematic review and meta-analysis.Int J Chron Obstruct Pulmon Dis. 2019; 14: 149-162. [ Özet ]
19) Yuce S, Uysal IO, Polat C, Müderris S. The TEOAE Results in Chronic Cigarette Users. KBB-Forum 2007;6(4) [ 20) Abdel Dayem AM, Galal IH, Naeem F, Hassan MA. Audiological assessment in patients with chronic obstructive pulmonary disease. Egypt J Bronchol. 2017;11:98-103.
21) Sonbay Yılmaz ND, Saka C, Oktay Arslan B, Aygener Yeşilyurt N, Saka D, Ardıç S. The effect of hypoxia on hearing function. Turk J Med Sci. 2019 Oct 24;49(5):1450-1454. [ Özet ]
22) Parlewar R, Shaikh R. Evaluation of Latencies and Interpeak Latencies of BAEP Waves in COPD Patients. Indian J Physiol Pharmacol. 2016 Apr;60(2):128-136. [ Özet ]
23) Hafez M R, Maabady M H, Aboelkheir O I, Elsheikh R M. Chronic obstructive pulmonary disease and its relation to im- pairment of visual and brainstem auditory evoked potentials. AAMJ. 2009; 7:3.
24) Davanipour Z, Lu NM, Lichtenstein M, Markides K.S. Hearing problems in Mexican elderly. Am J Otol. 2000; 21: 168-172. [ Özet ]
25) Hall. J. G.. The cochlea and the cochlear nuclei in neonatal asphyxia,a histological study Acta Otolaryngol Suppl. 1964:SUPPL 194:1-93. [ Özet ]
26) Nakano S, Imamura S, Tokunaga K, Tsuji S, Hashimoto I. Evoked potentials in patients with chronic respiratory insufficiency. Intern Med. 1997;36(4):270-275. [ Özet ]
27) Barbieri S, Fayoumi Z, Berardinelli P, Cappellari A, Cavestro C, Valli G, Scarlato G. Evidence for a subclinical involvement of the central nervous system in mild or moderate chronic respiratory insufficiency. Electromyogr Clin Neurophysiol. 1996;36(2):67-72. [ Özet ] ![]() Tam Metin ]
Tam Metin ]




