KRONİK RİNOSİNÜZİTİ OLAN HASTALARDA ULUSLARARASI FRONTAL SİNÜS ANATOMİ SINIFLAMASINA GÖRE FRONTAL HÜCRELERİN ANALİZİ
Özet
Amaç: Çalışmamızda Uluslararası Frontal Sinüs Anatomi Sınıflamasına göre frontal hücrelerin kronik rinosinüzit (KrRNS) tanısı alan hastalarda görülme sıklığını ve bu hücrelerin frontal sinüzit ile ilişkilerini kontrol olgularla karşılaştırarak değerlendirilmesi amaçlanmaktadır.Yöntemler: Ocak 2014 ile Mart 2019 arasında KrRNS tanısıyla tedavi planlanan ve tedavi öncesinde yüksek çözünürlüklü paranazal sinüs bilgisayarlı tomografisi (PNSBT) çekilmiş olgular ile hasta grubu oluşturuldu. KrRNS dışı endikasyonlar (kronik dakriosistit, başağrısı v.b.) nedeniyle PNSBT çekilmiş ve sinonazal patoloji izlenmeyen olgular kontrol grubuna dahil edildi.
Bulgular: KrRNS'li 62 hastanın (124 taraf) ile 65 kontrol grubu olgusu (130 taraf) çalışmaya dahil edildi. Supra-bullar hücre (SBH) , supra-bullar frontal hücre (SBFH) ve frontal septal hücrelerin (FSH) KrRNS'li grupta kontrol grubuna göre anlamlı derecede daha sık olduğu gözlendi (p=0.002, p<0.0001, p=0.001; sırayla). SBH, SBFH ve FSH ile frontal sinüzitin insidansı ve şiddetiyle de pozitif korele olduğu izlendi.
Sonuç: SBH, SBFH ve FSH gibi hücrelerin frontal sinüzit gelişiminde rol oynayabileceği akılda tutulmalıdır. Cerrahi tedavinin başarı şansını arttırmak için tedavi planında bu hücrelerin göz önünde bulundurulması gereklidir.
Giriş
Kronik rinosinüzit (KrRNS) nazal kavite ve paranazal sinüslerdeki enflamasyonun 12 haftadan daha fazla sürdüğü, hastanın hayat kalitesini düşüren, burun tıkanıklığı, burun/geniz akıntısı, fasiyal ağrı/basınç hissi ve koku almada azlık/yokluk ile karakterize bir hastalıktır [1]. Polipli ve polipsiz KrRNS olarak ikiye ayrılan bu hastalığın patogenezinde bir çok etiyolojik faktörün (immün yetmezlik, genetik, anatomik varyasyon, biyofilm, iyatrojenik, çevresel etkenler v.b.) olduğu belirtilse de günümüzde fizyolopatolojisi tamamen aydınlatılamamıştır [1]. KrRNS tedavisi kabaca medikal ve cerrahi tedaviler olarak ikiye ayrılmaktadır. Medikal tedavilerin başarısızlığında fonksiyonel endoskopik sinüs cerrahisi (FESC) sıklıkla tercih edilmekte ve bu cerrahinin hastaların hayat kalitesi üzerine olumlu etkilerinin olduğu bilinmektedir [1,2]. FESC'nin başarı şansını etkileyen en önemli faktörlerden birisi de cerrahinin tam ve eksiksiz yapılmasıdır.Uluslararası Frontal Sinüs Anatomi Sınıflaması (UFSAS), frontal sinüsü ve sinüsün direne olduğu frontal reses'i etkileyen hücreleri tanımlamakla birlikte eski klasifikasyonları da dikkate alarak 2016 yılında oluşturulmuş ve konsensusa varılmış yeni bir sınıflama sistemidir [3]. Bu sınıflama ile frontal sinüsü ilgilendiren patolojilerin elimine edilmesindeki başarının arttırılması aynı zamanda olası komplikasyonların önüne geçilmesi amaçlanmıştır. UFSAS'da hücre tanımlamaları bulundukları lokalizasyonlara, komşuluklarına ve uzanımlarına göre isimlendirilmektedir; drenaj yolunun önünde yer alan; agger nazi hücresi (ANH), supra-agger hücre (SAH), supra-agger frontal hücre (SAFH), arkasında yer alan; supra-bullar hücre (SBH), supra-bullar frontal hücre (SBFH), supra-orbital ethmoid hücre (SOEH) ve medialinde yer alan hücre; frontal septal hücre (FSH) (Tablo 1).
Tablo 1: Uluslararası Frontal Sinüs Anatomi Sınıflaması, Wormald ve ark. [3] çalışmasından modifiye edilmiştir.
Çalışmamızda KrRNS nedeniyle tedavisi planlanan hastaların UFSAS'a göre frontal hücre tipleri görülme sıklığının normal olgularla karşılaştırılması ve bu insidansın frontal sinüzit ile ilişkisinin ortaya konması amaçlanmıştır.
Yöntem ve Gereçler
Ocak 2014 ile Mart 2019 tarihleri arasında 18 yaş üstü KrRNS tanısıyla tedavisi planlanan ve yüksek çözünürlüklü paranazal sinüs bilgisayarlı tomografisi (PNSBT) çekilmiş olgular hasta grubuna dahil edildi. KrRNS dışı endikasyonlar (kronik dakriosistit, başağrısı v.b.) nedeniyle PNSBT çekilmiş ve sinonazal patoloji / PNSBT'de opasifikasyon izlenmeyen olgular kontrol grubu olarak belirlendi. Maksillofasiyal travma öyküsü, sinonazal benign/malign kitle, konjenital anormali, sinüs aplazisi/hipoplazisi, geçirilmiş sinonazal cerrahi, septum deviasyonu varlığı ya da düşük çözünürlüklü PNSBT görüntüleri olan olgular her iki grupta da çalışma dışı bırakıldı.Her iki gruptaki olguların multiplanar PNSBT görüntüleri RadiAnt görüntüleme yazılımı (Medixant, Poznan, Polonya) iki kör yazar (UU, TM) ile değerlendirildi, uyumsuzluklar üzerinde tartışıldı, konsensusa varılamayan olgular çalışma dışı bırakıldı. Koronal, sagittal ve aksiyal plandaki PNSBT görüntülerinde frontal hücrelerin klasifikasyonu UFSAS'a göre değerlendirildi [3]. Frontal sinüs opasifikasyonları Lund-Mackay evreleme sistemine göre hesaplandı [4]. Çalışma için etik kurul onayı alındı.
İstatistiksel analiz SPSS v.21 for Mac (IBM, Armonk, NY, ABD) yazılımı ile "Independent-samples t" ve ki-kare testleri ile değerlendirildi. Korelasyon analizi için Pearson's korelasyon testi kullanıldı. p değerinin 0.05'ten az olması istatistiksel olarak anlamlı kabul edildi.
Bulgular
62 KrRNS'li hastanın (28 Kadın, 34 Erkek) 124 taraf, 65 kontrol olgusunun (34 Kadın, 31 Erkek) 130 taraf PNSBT'leri retrospektif olarak değerlendirildi. Her iki grup arasında cinsiyet ve yaş açısından anlamlı farklılığın olmadığı izlendi (pCinsiyet=0.421; ortalama-yaşKrRNS = 40 ±11.19 yıl , ortalama-yaşKontrol = 42 ± 12.46 yıl , pYaş=0.360) (Tablo 2). 62 KrRNS'li hastanın 32'si polipsiz KrRNS iken 30'u ise polipli KrRNS hastalarından oluştuğu izlendi. Her iki grubun Keros derinliğinin KrRNS'li hastalarda ortalama 4.64 ±1.8 mm, kontrol hasta grubunda ortalama 5.37 ±6.2 mm olarak ölçüldü ve iki grup arasında anlamlı farkın olmadığı izlendi (p=0.205).KrRNS'li hastalarda frontal hücreler değerlendirildiğinde ANH'ın %96, SAH'ın %41.9, SAFH'nin %27.4, SBH'nin %39.5, SBFH'nin %31.5, SOEH'nin %10.5, FSH'nin %18.5 oranında olduğu izlendi (Tablo 2). Kontrol grubunda ANH'ın %91.5, SAH'ın %35.4, SAFH'nin %20.8, SBH'nin %21.5, SBFH'nin %13.1, SOEH'nin %7.7, FSH'nin %5.4 oranında olduğu gözlendi. Her iki grupta ANH (p=0.146), SAH (p=0.284), SAFH (p=0.215), SOEH (p=0.438) görülme sıklığı açısından anlamlı bir fark izlenmedi. SBH (p=0.002), SBFH (p<0.0001), FSH (p=0.001) tipi hücrelerin KrRNS'li hastalarda istatistiksel olarak anlamlı derece daha sık olduğu gözlendi (Figür 1). SBH ile frontal sinüs Lund-Mackay skoru arasında (rho=0.231, p<0.0001), SBFH ile Lund-Mackay skoru arasında (rho=0.219, p<0.0001) ve FSH ile Lund-Mackay skoru arasında (rho= 165, p=0.008) pozitif bir korelasyonun olduğu izlenirken diğer frontal hücreler ile Lund-Mackay frontal sinüs skoru arasında anlamlı bir korelasyonun olmadığı gözlendi.
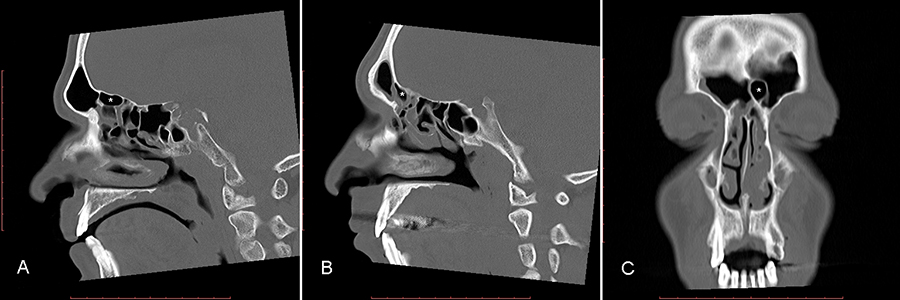 Büyütmek İçin Tıklayın |
Figure 1: A. Supra-bullar hücre (yıldız ile işaretli) B. Supra-bullar frontal hücre (yıldız ile işaretli) C. Frontal septal hücre (yıldız ile işaretli). |
Tartışma
Kronik rinosinüzit gelişiminin genellikle sinüs ostiumlarının obstrükte olmasından kaynaklandığı kabul edilmektedir [1]. Ostiumların obstrükte olmasında anatomik varyasyonlar ya da mukozal enflamatuvar süreçler ya da bu nedenlerin her ikisinin birlikteliği söz konusu olabilmektedir [1]. KrRNS'in tedavisinde medikal modalitelerden cevap alınamadığında cerrahi yöntem (FESC) tercih edilebilir ve hastalık elimine edilebilir. Ancak cerrahi tedaviye rağmen bazı hastalarda hastalığın tekrar ettiği bilinmektedir. Cerrahi tedavide başarısızlık nedenlerinden birisinin de tam olmayan cerrahi prosedür olabileceği belirtilmektedir[5]. FESC"nde en çok zorlanılan aşamalardan birisi de frontal sinüs aşamasıdır. Bu yüzden frontal sinüs cerrahisi ile ilgili başarısızlık oranı diğer sinüslere göre daha çok olabilmektedir. Başarısızlık oranını azaltmak için cerrahi öncesi frontal sinüste yer alan hücrelerin tanımlanması ve elimine edilmesi önemlidir. Bu hücreleri klasifiye etmek için günümüzde bir çok sınıflama kullanılsa da en güncel olanı UFSAS"dır. Bu yüzden çalışmada frontal sinüsün drenajına etkili olabilecek hücrelerin KrRNS"li hastalarda görülme sıklığını ve hücrelerin frontal sinüzit gelişiminde olası etkilerini araştırmak için UFSAS tercih edilmiştir.Agger nazi hücresi en önde havalanan ethmoid hücre olarak tanımlanmaktadır. Çalışmamızda ANH KrRNS olmayan grupta %91.5 oranında gözlenirken, KrRNS olan hastalarda bu oranın daha fazla (%96) olduğu izlenmiştir. Çalışmamıza benzer şekilde literatürde de ANH prevelansının %89-98 oranında olduğu izlenmektedir [6-9]. %80 üzerinde görülme sıklığından dolayı anatomik bir "landmark" olarak kullanılmakta ve frontal resese ulaşım için ANH'nin medial, tavan ve posterior duvarlarının eksize edilmesi gerekmektedir [10]. Böylesine önemli bir nirengi noktasının frontal sinüzit gözlenmesi ile bir ilişkisinin olmadığı ve her iki gruptaki görülme sıklığı açısından fark olmadığı da gözlenmiştir. Literatür de bu bulgularımızı desteklemektedir [8,11,12].
Frontal reses hücrelerinden olan ANH'ın üzerinde yer alan SAH ve SAFH de frontal reses'in önünde yer almaktadır. Çalışmamızda SAH ve SAFH kontrol grubunda %35.4 ve %20.8 oranında izlenirken KrRNS'li olgularda bu iki hücre biraz daha sık (%41.9, %27.8; sırayla) gözlenmektedir. Bulgularımıza benzer şekilde Choby ve ark. [9] yapmış olduğu çalışmada da SAH görülme sıklığının %30, SAFH'nin ise %20 düzeylerinde olduğunu belirtmişlerdir.
Frontal resesin arkasında ise SBH, SBFH ve SOEH'ler bulunmaktadır. SBH; bulla ethmoidalis'in hemen üstünde yer alır, ön duvarı bulla ethmoidalisin ön tarafı olarak devam eder ve frontal sinüse uzanım göstermezler [3]. SBH literatürde %55-72 oranında bulunurken [6,9], çalışmamızda kontrol grubunda %21.5 oranında gözlendi. Ancak SBH'nin KrRNS'li hastalarda kontrol grubuna göre anlamlı derecede daha sık (%39.5) olduğu izlendi (p=0.002). SBFH; kontrol grubunda %13.1 oranında gözlenirken, KrRNS'li hastalarda %31.5 oranında gözlendiği ve kontrol grubuna göre anlamlı derecede daha sık olduğu belirlendi (p<0.0001). Literatürde ise SBFH görülme sıklığının %6-19 oranında olduğu [6,9] ve kontrol grubu olguları ile benzer sonuçların olduğu dikkati çekmektedir. Yukarıdaki verilere göre SBH'in çalışmamızda görülme sıklığı literatüre göre daha seyrektir. Olası nedenlerden birisi ırksal farklılıklar iken, bir diğer neden de SBH ve SBFH'nin radyolojik ayrımının kolay olmamasından kaynaklanan tanım farklılıklarından dolayı olabilir. Çünkü ön tarafta yer alan SAH ile SAFH ayrımını yaparken "frontal beak" oldukça iyi bir nirengi noktası iken arka tarafta frontal sinüsün tam olarak nereden başladığı konusunda bazen net ayrım yapılamamaktadır. Burada dikkat edilmesi gereken durum; hücre gerçekten frontal sinüsün içine kadar ilerliyorsa SBFH, ilerlemiyorsa ve bulla ethmoidalisin hemen üstünde bitiyorsa SBH olarak isimlendirilmesinin daha uygun olacağıdır. Bir diğer posterior yerleşimli frontal sinüs hücresi SOEH'ler ise KrRNS'li hastalarda %10.5, kontrol grubunda ise %7.7 oranında olduğu gözlendi. Benzer şekilde Sjögren ve ark. [6] %12 oranında bu hücrelerin olduğunu belirtirken, Choby ve ark. [9] bu hücrelerin daha sık olduğunu (%29) bulmuşlardır.
Frontal septal hücreler, medial olarak yerleşen anterior ethmoid veya inferior frontal sinüs hücrelerdir. FSH, interfrontal sinüs septumuna tutunurlar. Özellikle bu hücrelerin varlığında frontal sinüs drenaj yolu laterale ve arkaya doğru yer değiştirir [3]. Literatürde %13-30 oranında olduğu belirtilen bu hücreler çalışmamızda KrRNS'li hastalarda %18.5 iken, normal hasta grubunda anlamlı olarak daha az (%5.4) oranda olduğu dikkati çekmiştir [6,9]. Literatürde UFSAS'ı kullanarak frontal sinüs hücrelerinin görülme sıklığını değerlendiren çalışma sayısı oldukça azdır, özellikle UFSAS kullanılarak KrRNS'li hastalar ile kontrol olguların karşılaştırıldığı herhangi bir çalışma literatürde yoktur.
Çalışmamızda UFSAS'ta yer alan frontal hücreler ile frontal sinüsün opasifikasyon dereceleri arasında ilişki değerlendirildi. ANH, SAH, SAFH ve SOEH ile frontal sinüzitin görülmesi ve şiddeti arasında bir korelasyonun olmadığını gözledik. Diğer yandan SBH, SBFH ve FSH ile frontal sinüste sinüzit varlığı ve derecesi arasında anlamlı bir pozitif korelasyonun olduğunu belirledik. Bu bulgularımıza rağmen eski sınıflandırmaların kullanıldığı çalışmalarda interfrontal septal hücreler ile supra bullar hücrelerin frontal sinüzit ile bir bağlantısının olmadığı belirtilmiştir [8,13]. Bu farklılığın nedeni çalışmamızda grupların daha homojen yapıda olmasından kaynaklandığını düşünmekteyiz. Çünkü literatürdeki çalışmalarda septum deviasyonu olan hastalar da değerlendirmeye alınmışken, çalışmamızda septum deviasyonu olan olgular çalışma dışı bırakılmıştır. Septum deviasyonunun sinüzit için predispozan bir faktör olabileceği bilinmektedir, bu yüzden PNSBT'de sadece septum deviasyonunun neden olduğu opasifikasyonlar izlenebilir ve hücrelere bağlı olmaksızın bu olgular için yanlış pozitif sonuçlar gözlenebilir [14]. Yukarıdaki bilgilere ek olarak frontal drenaj yolunu etkileyen hücrelerin varlığı da revizyon cerrahi gereksinimi için yüksek risk taşımaktadır [5]. Benzer şekilde frontal sinüs ostiumunun 4 mm'den dar olması revizyon cerrahi için bir risk faktörü olabileceğine dair çalışmalar da vardır [15].
Çalışmamızın limitasyonları retrospektif natürde olması ve hastaların hastalık-spesifik hayat kalitesini değerlendiren herhangi bir test bataryasının kullanılmamış olmasıdır.
Sonuç
Sonuç olarak çalışmamızda literatürde yeni kabul edilen bir sınıflamaya göre özellikle SBH, SBFH ve FSH'ların frontal sinüzit görülmesi ve derecesi ile korele olduğu bulunmuştur. FESC'de bu hücrelerin görülmesi ve elimine edilmesi tedavinin başarı şansını arttırabileceği gibi, revizyon oranını azaltabileceği ve olası komplikasyonların önlenmesinde de yararlı olabileceği akılda tutulmalıdır.Maddi ve Teknik Destek: Araştırma için alınmış maddi destek ve teknik destek bulunmamaktadır.
Kaynaklar
1) Fokkens WJ, Lund VJ, Mullol J, Bachert C, Alobid I, Baroody F, et al. European Position Paper on Rhinosinusitis and Nasal Polyps 2012. Rhinol Suppl. 2012 Mar;23:3 p preceding table of contents, 1-298. [ Özet ]
2) Uz U, Gunhan K, Yilmaz H, Unlu H. The evaluation of pattern and quality of sleep in patients with chronic rhinosinusitis with nasal polyps. Auris Nasus Larynx. 2017 Dec;44(6):708-12. [ Özet ]
3) Wormald PJ, Hoseman W, Callejas C, Weber RK, Kennedy DW, Citardi MJ, et al. The International Frontal Sinus Anatomy Classification (IFAC) and Classification of the Extent of Endoscopic Frontal Sinus Surgery (EFSS). Int Forum Allergy Rhinol. 2016 Jul;6(7):677-96. [ Özet ]
4) Lund VJ, Mackay IS. Staging in rhinosinusitus. Rhinology. 1993 Dec;31(4):183-4. [ Özet ]
5) Benkhatar H, Khettab I, Sultanik P, Laccourreye O, Bonfils P. Frontal sinus revision rate after nasal polyposis surgery including frontal recess clearance and middle turbinectomy: A long-term analysis. Auris Nasus Larynx. 2018 Aug;45(4):740-6. [ Özet ]
6) Sjogren PP, Waghela R, Ashby S, Wiggins RH, Orlandi RR, Alt JA. International Frontal Sinus Anatomy Classification and anatomic predictors of low-lying anterior ethmoidal arteries. Am J Rhinol Allergy. 2017 May 1;31(3):174-6. [ Özet ]
7) Cho JH, Citardi MJ, Lee WT, Sautter NB, Lee HM, Yoon JH, et al. Comparison of frontal pneumatization patterns between Koreans and Caucasians. Otolaryngol Head Neck Surg. 2006 Nov;135(5):780-6. [ Özet ]
8) Johari HH, Mohamad I, Sachlin IS, Aziz ME, Mey TY, Ramli RR. A computed tomographic analysis of frontal recess cells in association with the development of frontal sinusitis. Auris Nasus Larynx. 2018 Dec;45(6):1183-90. [ Özet ]
9) Choby G, Thamboo A, Won TB, Kim J, Shih LC, Hwang PH. Computed tomography analysis of frontal cell prevalence according to the International Frontal Sinus Anatomy Classification. Int Forum Allergy Rhinol. 2018 Jul;8(7):825-30. [ Özet ]
10) Wormald PJ. The axillary flap approach to the frontal recess. Laryngoscope. 2002 Mar;112(3):494-9. [ Özet ]
11) DelGaudio JM, Hudgins PA, Venkatraman G, Beningfield A. Multiplanar computed tomographic analysis of frontal recess cells: effect on frontal isthmus size and frontal sinusitis. Arch Otolaryngol Head Neck Surg. 2005 Mar;131(3):230-5. [ Özet ]
12) Angelico FV, Jr., Rapoport PB. Analysis of the Agger nasi cell and frontal sinus ostium sizes using computed tomography of the paranasal sinuses. Braz J Otorhinolaryngol. 2013 May-Jun;79(3):285-92. [ Özet ]
13) Langille M, Walters E, Dziegielewski PT, Kotylak T, Wright ED. Frontal sinus cells: identification, prevalence, and association with frontal sinus mucosal thickening. Am J Rhinol Allergy. 2012 May-Jun;26(3):e107-10. [ Özet ]
14) Caughey RJ, Jameson MJ, Gross CW, Han JK. Anatomic risk factors for sinus disease: fact or fiction? Am J Rhinol. 2005 Jul-Aug;19(4):334-9. [ Özet ]
15) Naidoo Y, Bassiouni A, Keen M, Wormald PJ. Risk factors and outcomes for primary, revision, and modified Lothrop (Draf III) frontal sinus surgery. Int Forum Allergy Rhinol. 2013 May;3(5):412-7. [ Özet ]




